

















Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
caracteristicas de las diferentes volumetrias
Tipo: Diapositivas
1 / 26

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!



















“ Es una técnica clásica que da origen a una metodología
absoluta , que se basa en el empleo de estándares químico-
analíticos que reaccionan univoca y estequiométricamente
con el analito” (Miguel Valcarcel)
Método de análisis que consiste en la medición precisa del
volumen de un reactivo en disolución de concentración
perfectamente conocida, que es necesario para reaccionar
estequiométricamente con el analito contenido en un
volumen exactamente medido de la muestra.
Los métodos volumétricos tienen la misma exactitud que
los gravimétricos, pero tienen la ventaja de ser más rápidos
y cómodos. Además, la misma naturaleza de estos
métodos permite trabajar con muestras más pequeñas o
con soluciones más diluidas.
El análisis volumétrico se basa en la medición precisa de
los volúmenes de las soluciones de sustancias que
reaccionan entre sí.
Se mide el volumen de una solución de concentración
exactamente conocida que se necesita para reaccionar, de
forma completa, con el analito (sustancia a analizar).
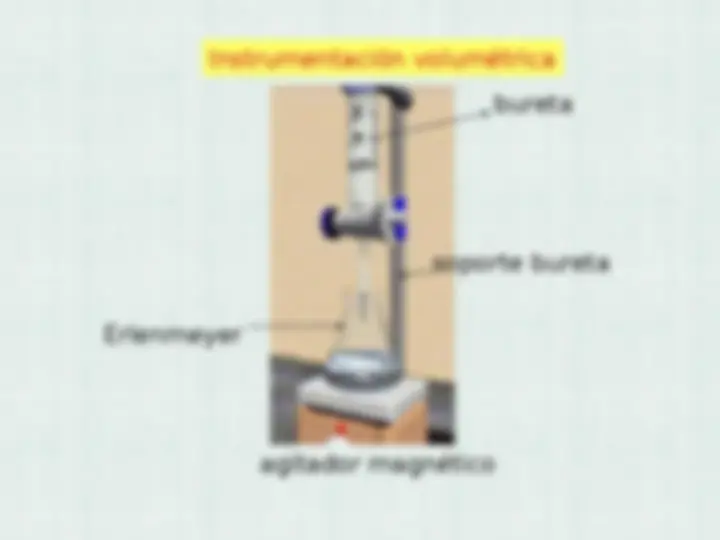
bureta
soporte bureta
agitador magnético
Erlenmeyer
Instrumentación volumétrica
matraz
aforado
bureta
pipeta aforada
pipeta
automática
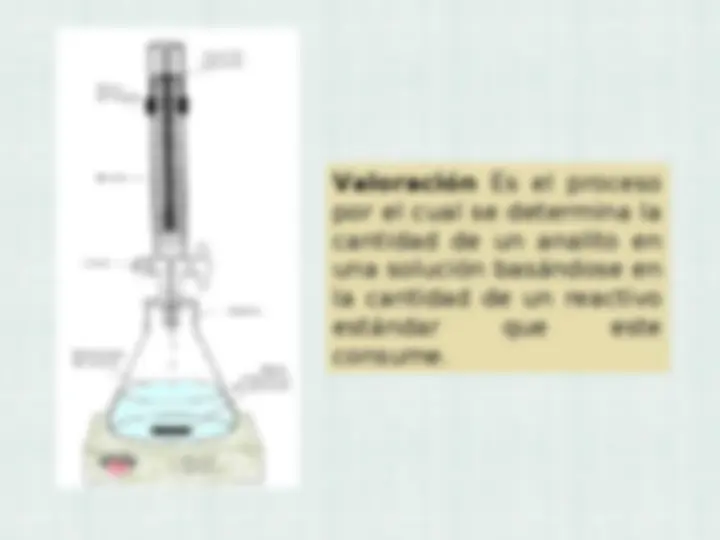
Valoración Es el proceso
por el cual se determina la
cantidad de un analito en
una solución basándose en
la cantidad de un reactivo
estándar que este
consume.
quelatometrías)
La reacción volumétrica debe poseer
1.Constantes elevadas (Estequiometría,
Selectividad y ser cuantitativas)
2.Cinéticas favorables (rapidez)
3.Indicadores adecuados
punto final (químico o instrumental).
valoración:
añadido
Un patrón o estándar primario, es un compuesto
de elevada pureza, que sirve como material de
referencia en todos los métodos volumétricos.
Es aquella droga que por simple pesada y
disolución en un volumen perfectamente
conocido da una solución de título exacto
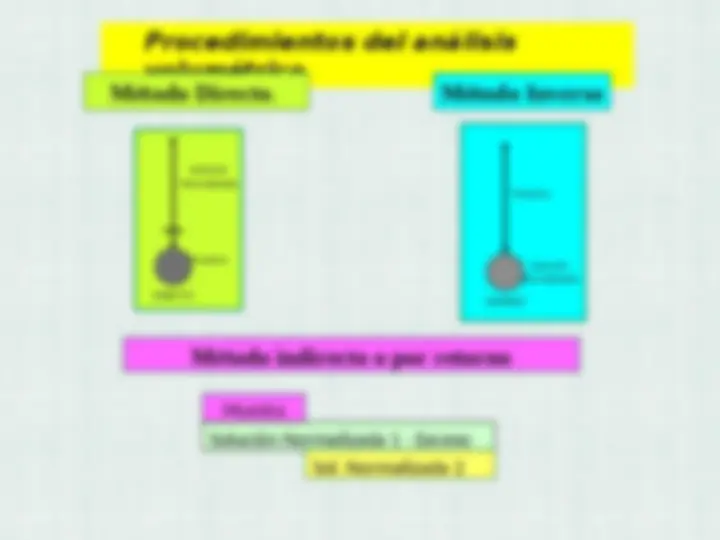
Método directo : El patrón primario se seca, se pesa con
exactitud una determinada cantidad del compuesto, se
disuelve, se diluye y se enrasa cuidadosamente a un
volumen exactamente conocido, en un matraz aforado.
Método indirecto: se usa cuando el compuesto químico
no es un patrón primario. Se prepara una disolución de
concentración aproximada y se estandariza frente a un
patrón primario.
La estandarización o Normalización es un proceso por
el cual se determina la concentración exacta de una
disolución. La disolución se utilizará para valorar una
cantidad conocida de otro reactivo.
La disolución valorante obtenida de esta forma se
denomina disolución patrón secundario o estándar
secundario.
“representación gráfica de la variación de concentración
de la sustancia valorada (analito) con las cantidades
crecientes (volumen) de agente valorante” c = f(v) o %
(valoración) = f(v) Debe presentar saltos nítidos en las
proximidades del p.e.
volumen
p.e.
Este error está compuesto por:
diferencia entre el PF y el Pe.
Ev = Vpf – Vpe
colores.
el propio indicador para que se transforme y de lugar al cambio
observable.
p.e.
P. F.
+ 0,1 %
- 0.1%
La diferencia existente ente la concentración
real del analito en la disolución y la hallada
experimentalmente constituye el error de
valoración.
Indicadores químicos ó visuales
Auto-indicadores.
Indicadores coloreados.
Indicadores fluorescentes.
Indicadores de adsorción.
Potenciométricas,
Conductimetrías,
Amperometrías,
Espectrofotometricas
Métodos instrumentales ,
incoloro