





























Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
apuntes de quimica analitica general volumetrias
Tipo: Apuntes
1 / 39

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!
































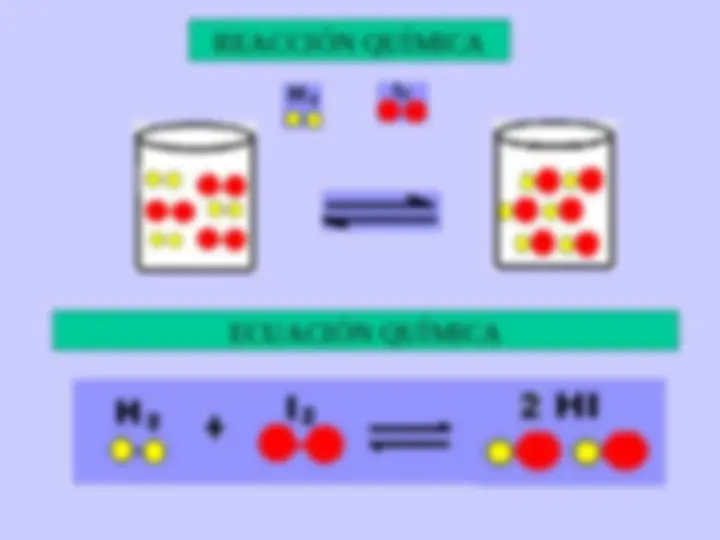
LAS ESPECIES QUÍMICAS (átomos, moléculas poli-atómicas,
neutras o con cargas eléctricas) INTERACCIONAN ENTRE SÍ
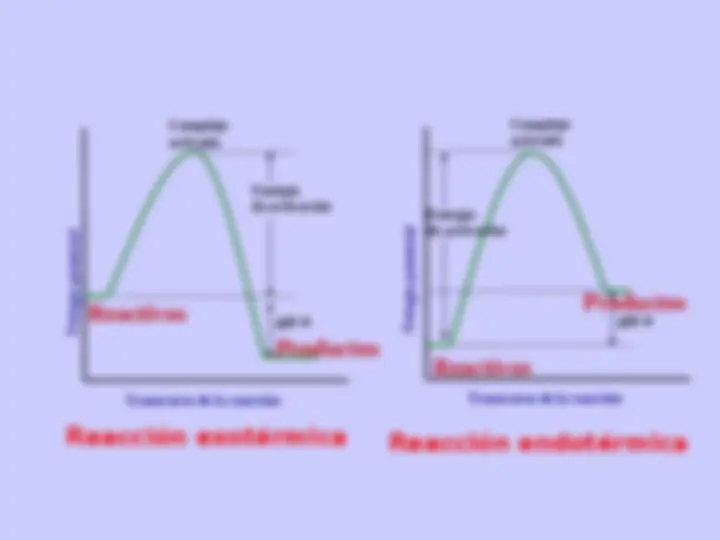
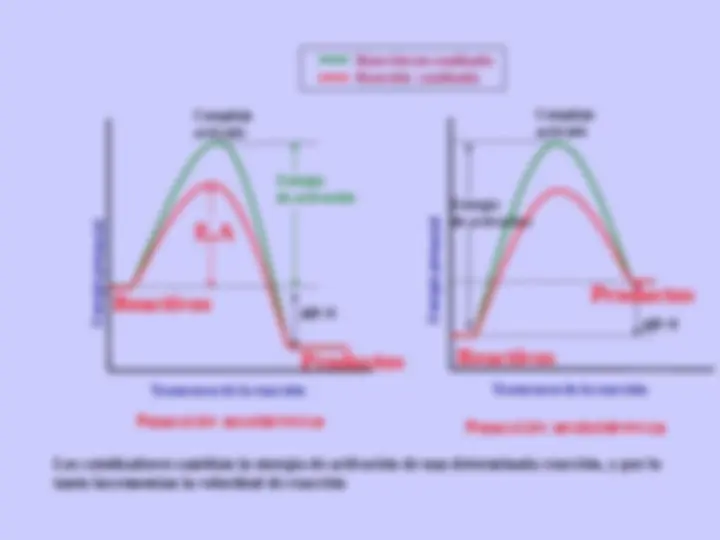
UNIÓN MÁS
ESTABLE
LIBERARON
MUCHA ENERGÍA
PARA
FORMARSE
UNIÓN MENOS
ESTABLE
LIBERARON POCA
ENERGÍA PARA
FORMARSE
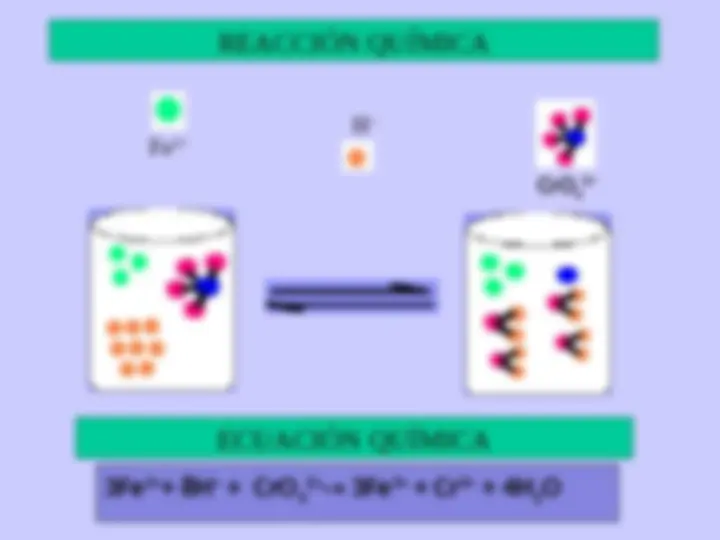
2+
+
4
2=
3+
3+
2
CrO
4
2=
Fe
3+
REACCIÓN DIRECTA
REACCIÓN INVERSA
a A + b B c C + d D
se mantiene constante
de los reactantes permanece constante.
y de destrucción de especies también se mantiene
constante
Atkins “ el estado de equilibrio dinámico es alcanzado
punto de inicio, cuando dos procesos inversos ocurren
simultánea y continuamente a la misma velocidad, por lo
cual la composición del sistema permanece constante”.
El equilibrio del sistema N
2
O
4
-NO
2
N 2
O 4
congelado
es incoloro
Si el sistema es una sustancia pura,
Si está a Temperatura y Presión constante
Si se encuentra en una sola fase,
quiere decir que el sistema está en equilibrio.
Es decir que no hay reacciones químicas
Entonces:
Si dn = 0
dG = 0 a T y P constante.
La Energía Libre “G” es una propiedad extensiva
Sólo para sistemas de un componente, el potencial químico es
igual a la energía libre molar.
Para calcular la variación de la energía de Gibbs debemos calcular “ dG” para α
y β, de tal forma que dG total será la suma de las dos componentes:
Sistema de dos fases (α y β) y por un solo componente
donde se transportan n moles de α a β
A T y P = cte.
Como n sale de α y va a β, dn = dn , con signo contrario
A T y P constantes el sistema estará en equilibrio cuando la suma de
los potenciales químicos multiplicados por la variación en el número
de moles iguala a 0.
dG dG dGtotal
dn
P
G
dP
P
G
dT
T
G
dG
P T T , P
( ) ( ) ( )
dG ( ) dn
dn dn dG
dG 0 ( ) dn 0 ........( Ecuación 1
Los cambios químicos que ocurren en disolución acuosa pueden ser
reversibles y establecer un equilibrio, y sus características son las
del equilibrio químico en general.
Un sistema en el que tenga lugar un proceso espontáneo, tiende a un
estado de equilibrio en el cual las variables del sistema permanecen
constantes.
En un sistema en el que tenga
lugar una reacción química, el
equilibrio se puede cuantificar
mediante la constante de
equilibrio “K”.
[C]
c
[D]
d
KEQ =----------
[A]
a
[B]
b
G = - R T ln K
Davies
Donde A y B son constantes
que dependen del disolvente
y de la temperatura, y ai, un
parámetro semi-empírico
que tiene en cuenta el
tamaño del ión (A=0,509;
B=0,