









Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
El descubrimiento de las PMO en el uso de Cirugia bucal
Tipo: Apuntes
1 / 14

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!









Las (PMO) son un conjunto de proteínas endógenas que pertenecen a la familia de factor de crecimiento transformante beta (TGF-b) que tienen la capacidad de inducir la formación de hueso nuevo, cartílago y tejido conjuntivo. Descritas por el Dr. Marshall Urist en 1965, al implantar matriz ósea desmineralizada extraída de bovino a nivel intramuscular en ratas y conejos y observar la producción ósea ectópica en el sitio de implantación; él lo denominó formación ósea por autoinducción. Urist atribuyó el proceso a la presencia de una proteína que atrae células mesenquimáticas pluripotenciales e induce formación ósea local, por lo que la denominó proteína morfogenética ósea (BMP).Estas tienen un peso molecular alrededor de 30000 Da. Y se han aislado en 40 tipos de tejidos diferentes. Donde están relacionadas con actividad osteogenica y angiogenica. Sin embargo sólo la BMP- 2, BMP-7 y BMP-9 son capaces de promover la osteoinducción. Pese a que BMP es una proteína endógena que puede ser obtenida de tejido óseo desmineralizado, su aislamiento es inviable debido a que se encuentra en mínimas cantidades. Estudios descritos en bovinos mostraron que es posible obtener 57 mg de un extracto rico en BMPs por kilo de hueso fresco. Sin embargo, luego de realizar los procesos de purificación y aislamiento de una BMP en específico, el rendimiento se redujo a unos cuantos ng de BMP por kg de hueso. Por otra parte, basados en las posibles reacciones inmunológicas que pueden ocasionar la utilización de tejido óseo bovino, en la década de los 80, se logró adquirir la secuencia de homólogos humanos de BMP bovina, las cuales se introdujeron en células mamíferas para inducir la secreción de BMP. Esta herramienta de recombinación genética permitió generar una mayor concentración de BMP y de mejor calidad en términos de su homogeneidad. Actualmente, las proteínas morforgenéticas recombinantes humanas (rhBMP) más estudiadas y utilizadas son los tipos rhBMP-2 y rhBMP-7. El desarrollo de las proteínas morfogenéticas óseas (PMO) ofrece una alternativa al tradicional injerto óseo, el cual ha sido el estándar de oro para la reconstrucción oral y maxilofacial. Exitosamente se han usado en primates para restaurar mandíbulas hemisectadas y grandes defectos óseos de tamaño crítico. Entre otros la reparación de fisuras alveolares e inducción de la formación ósea en los senos maxilares previa a la colocación de implantes, donde la aplicación clínica de las (PMO) ha incluido la
reparación de defectos óseos faciales, alveolares, mandibulares y maxilares. Estructura molecular y actividad biológica Las proteínas morfogenéticas óseas en términos generales son moléculas diméricas constituidas por aproximadamente 120 aminoácidos, siendo una secuencia de aminoácidos muy estable; se calcula que existe hace 600 millones de años. Todos los tipos de BMP presentan siete residuos de cisteína y la ubicación de éstos residuos son idénticos en todos los miembros de la familia de TGF-b. El segmento maduro se ha preservado en todos los organismos, seis de los residuos de cisteína son estabilizados por tres enlaces disulfuro formando una estructura molecular como "nudo de cisteína". Es producida en el tejido óseo por células osteoprogenitoras, osteoblastos, condrocitos, plaquetas y células endoteliales. Posterior a la formación de BMP, ésta se almacena temporalmente en la matriz extracelular durante periodos de reparación y remodelación ósea. La actividad biológica de la BMP ocurre mediante la formación de estímulos que desencadenan una formación ósea endocondral. El mecanismo de acción de las BMP es mediado por la quimiotaxis de monocitos, los cuales producen TGF-b y a su vez promueven la quimiotaxis y proliferación de células mesenquimáticas. BMP induce la diferenciación de éstas células a condrocitos, dicho fenómeno es seguido por una hipertrofia de los condrocitos, calcificación de la matriz ósea, diferenciación de osteoblastos y finalmente la formación ósea. La calidad del tejido óseo formado con BMP es indistinguible del tejido óseo formado sin BMP; sin embargo, las diferencias radican en la velocidad y en la dirección de la formación del tejido óseo.
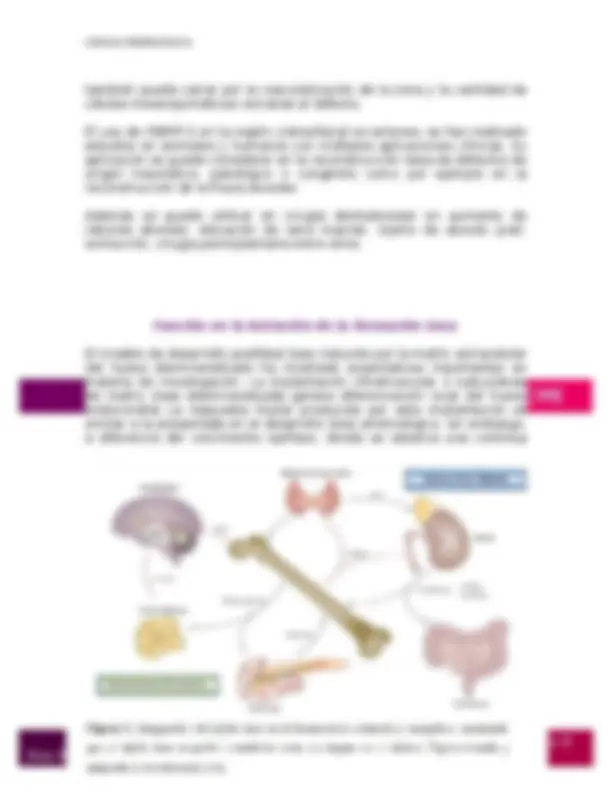
también puede variar por la vascularización de la zona y la cantidad de células mesenquimáticas cercanas al defecto. El uso de rhBMP-2 en la región cráneofacial es extenso; se han realizado estudios en animales y humanos con múltiples aplicaciones clínicas. Su aplicación se puede considerar en la reconstrucción ósea de defectos de origen traumático, patológico o congénito como por ejemplo en la reconstrucción de la fisura alveolar. Además se puede utilizar en cirugía dentoalveolar en aumento de reborde alveolar, elevación de seno maxilar, injerto de alveolo post- extracción, cirugía perimplantaria entre otros. Función en la iniciación de la formación ósea El modelo de desarrollo postfetal óseo inducido por la matriz extracelular del hueso desmineralizado ha mostrado expectativas importantes en materia de investigación. La implantación intramuscular o subcutánea de matriz ósea desmineralizada genera diferenciación local del hueso endocondral. La respuesta tisular producida por esta implantación es similar a la presentada en el desarrollo óseo embriológico, sin embargo, a diferencia del crecimiento epifíseo, donde se observa una continua
diferenciación ósea y cartilaginosa, en el modelo de matriz ósea inducida se evidencia un solo ciclo de formación endocondral. Ha sido difícil la identificación de proteínas osteogénicas en la matriz ósea debido a que pequeñas cantidades de ellas se adhieren fuertemente a componentes orgánicos e inorgánicos de la matriz ósea extracelular. La existencia de proteínas morfogenéticas óseas ha sido confirmada, debido a que la matriz ósea desmineralizada puede ser disociativamente extraída e inactivada con agentes caotrópicos (4 M guanidina-HCL) y osteogénicamente restaurada por reconstituyentes que inactivan residuos (matriz insoluble de colágeno) con fracciones de proteínas solubilizadas. Se debe destacar, que indiferente de su solubilidad o no, la matriz colágena se activa y una combinación de las dos formas restaura la actividad osteoinductiva. Esta reconstitución operacional de la señal soluble con un substrato insoluble ha sido el punto clave experimental que ha proporcionado bioensayos auténticos para la diferenciación de cartílago y hueso. Este bioensayo funcional proporciona el punto de partida para la depuración de las proteínas morfogenéticas óseas, que fueron evaluadas por clonación molecular y por expresión de proteínas humanas recombinantes. Una de las proteínas morfogenéticas óseas, la osteogenina, se aisló de una matriz ósea bovina por cromatografía de afinidad a la heparina y fue purificada por una solución electroendosmótica después de electroforesis. La secuencia de aminoácidos de los péptidos de la osteogenina reveló una estructura única primaria, idéntica a la secuencia de aminoácidos observada a partir de los clones de ADN de la proteína morfogenética
Es importante para aplicaciones futuras el concepto de que la inducción óptima de formación ósea depende de la acción combinada de PMO y un sustrato complementario. El compuesto del sustrato de la matriz extracelular en estado sólido, en asociación con PMO solubles, inicia la cascada de diferenciación ósea. La restauración de la actividad biológica después de la extracción disociativa y reconstrucción de la PMO con matriz de colágeno insoluble indica que los componentes de la matriz extracelular ósea actúan como un vehículo para la expresión funcional de las PMO. Algunas investigaciones han demostrado que el colágeno de la matriz ósea proporciona un sustrato óptimo para el reclutamiento y adhesión de células progenitoras y la posterior proliferación y diferenciación en
osteoblastos. La fundamentación de la matriz de colágeno en el desarrollo y diferenciación ha sido manifestada tempranamente, demostrando que la matriz de colágeno puede prevenir la difusión prematura en la implantación quirúrgica, y puede proteger la PMO de proteólisis no específica. El colágeno transportador actúa como substrato provisional hasta ser reemplazado por nuevo hueso formado. Aplicaciones clínicas Reconstrucción oral y Maxilofacial Tratamientos que requieren recuperar la salud, función y estética bucal del paciente. Cuando se presenta…
Han demostrado que el colágeno de la matriz ósea proporciona un sustrato óptimo para el reclutamiento y adhesión de células progenitoras se proliferan. (Células madre adultas). O células progenitoras, las células madre adultas pueden obtenerse bien a partir de las reservas que el organismo adulto mantiene con el fin de reparar los daños que se producen en los tejidos, o bien de las células presentes en el cordón umbilical. La matriz de colágeno puede prevenir la difusión prematura en la implantación quirúrgica.
DIFUSION PREMATURA: es un proceso físico irreversible en el que partículas se introducen a la membrana celular y hacen un desorden molecular. El colágeno transportador actúa como sustrato provisional hasta ser remplazado por nuevo hueso formado. Defectos de continuidad mandibular Son defectos secundarios a la resección de tumores que resultan en una morbilidad significante sino son quirúrgicamente reconstruidos, convirtiendo de esta manera a los injertos autógenos en una alternativa importante para dicha reconstrucción. Toriumi y colaboradores, emplearon un modelo canino para estudiar PMO-2 para estimular crecimiento en un defecto de continuidad mandibular, encontrando que el 68% del defecto fue reemplazado por hueso mineralizado. Boyne encontró que la PMO-2 fue un inductor efectivo de la regeneración ósea en primates con defectos óseos de tamaño crítico. En 2004, Warnke y colaboradores, usaron PMO-7 y bloques de hueso mineralizado (xenoinjertos), para crear injertos vasculares izados en humanos, hallando remodelación ósea y mineralización. El desarrollo de procedimientos de reconstrucción efectivos utilizando factores osteoinductivos sin necesidad de injertos óseos, tendría un fuerte impacto sobre las cirugías reconstructivas de cabeza y cuello. Aumento preprotésico maxilomandibular Este tipo de aumentos usando injertos óseos y sustitutos óseos son muy frecuentes. Los procedimientos más comúnmente empleados incluyen aumento de rebordes y elevación de seno maxilar. Jovanovic y colaboradores, realizaron un estudio histológico en un modelo animal en el que se llevó a cabo un aumento de reborde alveolar. No encontraron diferencias significativas entre los injertos con PMO- osteoinducidos, comparado con el hueso residente, estableciendo que la PMO-2 permite la instalación, oseointegración y carga funcional a largo plazo en implantes dentales ubicados en perros.14 Boyne y colaboradores, publicaron recientemente los resultados de un estudio multicéntrico en el que se evaluaba PMOrh en el seno maxilar, 4 concluyendo que la PMO inducía hueso de una manera predecible y segura, adecuada para la carga funcional de implantes endóseos en aquellos pacientes que requieren aumento del seno maxilar.
Más de 40 PMO han sido aisladas con diferentes habilidades para aumentar la osteogenesis. Las tipo 2, 4, 7, al parecer tienen la mayor habilidad para estimular la formación ósea. Un sustrato ideal que actúe como un sistema de distribución osteogénico debe ser inorgánico, no inmunogénico y sensible para una óptima adhesión y también debe proporcionar soporte completo al colgajo mucoperióstico. Ventajas
http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130- https://repository.icesi.edu.co/biblioteca_digital/bitstream/10906/83537/1/T01297.pdf https://scielo.conicyt.cl/scielo.php?script=sci_arttext&pid=S0717-