











































Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
clase de proteinas........................................................
Tipo: Apuntes
1 / 65

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!


























































(^) La facilidad con que se precipitan muchas proteínas ha dado como resultado una amplia serie de métodos para su cuantificación basados en este fenómeno. (^) Se utilizan reactivos específicos, y la turbidez producida se compara con una solución de composición conocida (^) Se usan ácidos orgánicos, como el ácido tricloroacético, el ácido pícrico, o el salicilsulfónico, y la turbidez resultante se mide o bien por comparación visual o fotométricamente. (^) Pueden utilizarse también como agentes precipitantes anticuerpos (sensibilidad y especificidad) (^) El peso específico de una solución de proteína aumenta con el contenido de ésta, esto puede utilizarse como un método cuantitativo sencillo. El método no es muy exacto y la presencia de otros solutos además de las proteínas influyen en él.
(^) El aumento de la fuerza iónica (hasta un determinado punto) aumenta la solubilidad, incluso en el punto isoeléctrico. Este efecto de disolver las proteínas incrementando la concentración salina se denomina “salting in”. (^) En soluciones salinas muy concentradas, gran parte del agua que normalmente solvataría la molécula de proteína está enlazada en las capas de hidratación de numerosos iones salinos, impidiendo una hidratación suficiente de la proteína. Así, con concentraciones salinas extremadamente altas, la solubilidad de una proteína disminuye de nuevo, un efecto denominado “salting out”. (^) Puesto que proteínas diferentes responden de modo diferentes a esos dos efectos, con frecuencia se utiliza el “salting in” y el “salting out” para purificar las proteínas
(^) El coeficiente de sedimentación tiene unidades de segundos. Los valores típicos para las moléculas se encuentran cerca de por lo que esta cantidad se ha designado como 1 unidad Svedberg (S). (^) Por ejemplo, el coeficiente de sedimentación de la hemoglobina es de aproximadamente 4.10-13s, o 4 S. (^) Las partículas celulares suelen identificarse por su valor de S, por ejemplo: ribosoma 70 S. (^) S aumenta con la masa de la partícula, pero la relación no es lineal. (^) A pesar de que podemos utilizar la sedimentación como una medida estimativa del peso molecular, la relación es sólo aproximada. (^) Puesto que las partículas o moléculas de distinto tamaño difieren en cuanto a S, y en consecuencia también difieren en su velocidad de sedimentación, la sedimentación es una herramienta útil para la separación
(^) Diálisis: a través de una membrana semipermeable pequeñas moléculas pueden ser removidas de una solución de proteínas (^) Cromatografía por exclusión molecular: una columna de un polímero tipo carbohidrato hidratado en forma de pequeñas esferas de 0,1 mm de diametro retiene moleculas pequeñas momentaneamente y las grandes eluyen fácilmente S uele ser una alternativa a la sedimentación. Constituye un método adecuado para separar macromoléculas de tamaño diferente o para eliminar contaminantes debajo peso molecular de soluciones de moléculas grandes
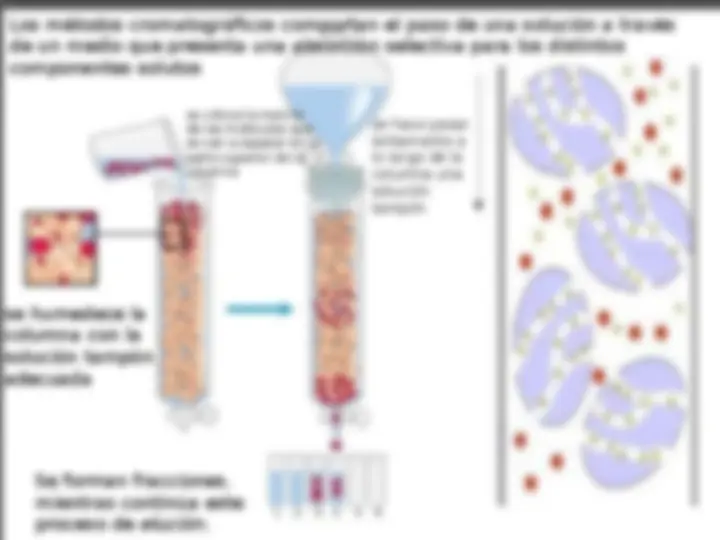
Los métodos cromatográficos comportan el paso de una solución a través de un medio que presenta una absorción selectiva para los distintos componentes solutos se humedece la columna con la solución tampón adecuada se coloca la mezcla de las moléculas que se van a separar en la parte superior de la columna se hace pasar lentamente a lo largo de la columna una solución tampón Se forman fracciones, mientras continúa este proceso de elución.
(^) Cromatografia de intercambio iónico (^) La cromatografía de intercambio iónico se utiliza para separar moléculas de acuerdo con su carga eléctrica. (^) Se utilizan resinas de intercambio iónico , que son polianiones o policationes. (^) Los aumentos de concentración salina tienden a romper las interacciones electrostáticas de este tipo, puede utilizarse un gradiente salino una vez recogidas las primeras fracciones..
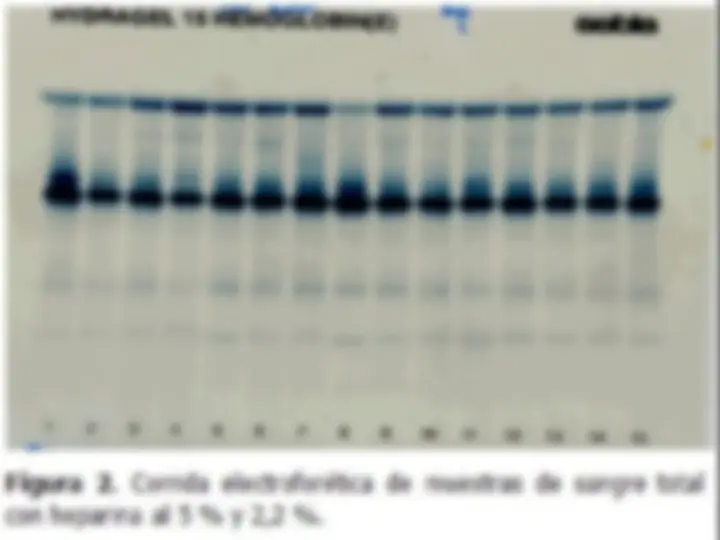
Electroforesis: -Migración hacia el cátodo o hacia el ánodo según su carga cuando se aplica un campo eléctrico a una solución
- Depende de la carga de las moléculas y del tamaño y forma -La movilidad electroforética (u) está en relación a la velocidad de migración (v) y la fuerza del campo (E) u=v/E medido en cm2/volt.seg -Se utiliza una matriz sólida o soporte: papel de filtro, gel de agarosa, gel de poliacrilamida -En el punto isoeléctrico la proteína no se mueve
La electroforesis en papel suele emplearse para separar mezclas de moléculas pequeñas cargadas.
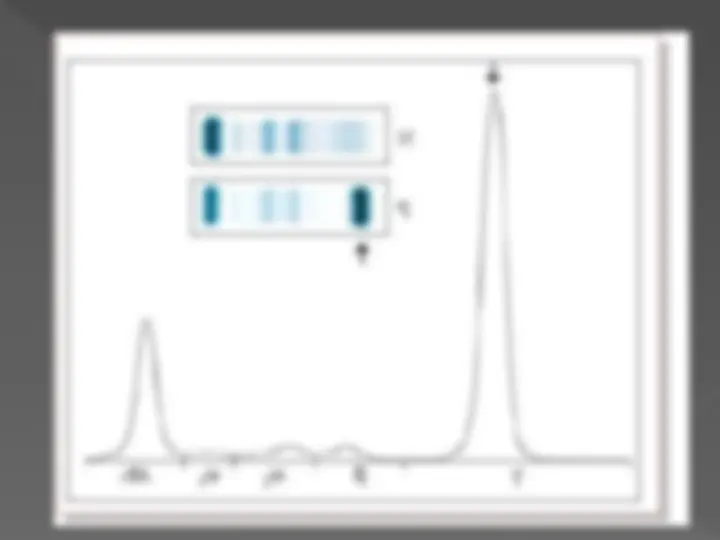
Determinación del número y peso aproximado de las subunidades de proteínas: electroforesis en gel SDS