



Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
EJERCICIOS RESUELTOS DE MATEMATICA
Tipo: Ejercicios
1 / 4

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!



Demostrar experimentalmente la complexometría producida entre un agente valorante aminocarboxílico(EDTA) y el ión metálico Magnesio a un pH alcalino Realizar los cálculos necesarios para determinar la concentración del ión metálico en la disolución de interés en ppm
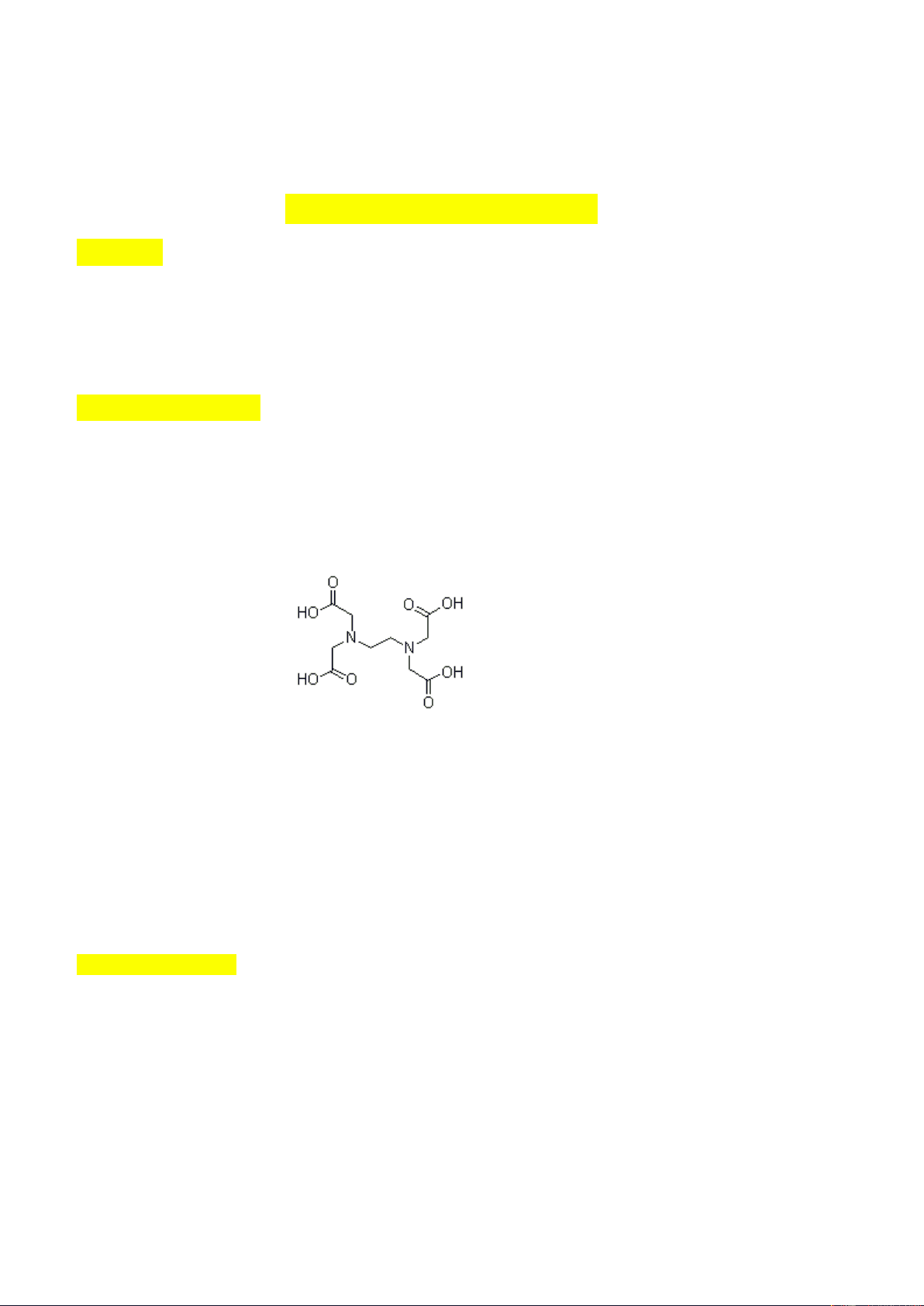
Las valoraciones complexométricas son una forma de análisis volumétrico en la que la formación de los complejos indica el punto final de la valoración, lo cual se evidencia por un cambio de color cuando se utiliza algún tipo de indicador El ácido etilendiaminotetraacético es el valorante complexométrico mas utilizado. Su fórmula estructural es: La molécula de EDTA contiene seis posibles sitios de enlace con un ión metálico: los cuatro grupos carboxilo y los dos grupos amino cada uno de éstos últimos con un par de electrones no compartidos. Así el EDTA es un ligando hexadentado Las constantes de disociación de los grupos ácidos del EDTA son : K1=1.02x10-2 ,k2=2.14x10-3, k3=6.92x10-7, k4= 5.50x10- 11 El ácido libre H4Y y la sal disódica dihidratada Na2H2Y.2H2O están disponibles comercialmente con calidad de reactivos Materiales y Reactivos
Solución de EDTA: