









Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
Una detallada descripción de la estrategia básica del metabolismo, enfocándose en la formación de atp, los procesos de gluconeogénesis, glucogenogénesis, glucolisis, glucogenolisis, síntesis y degradación de ácidos grasos, ciclo de krebs, cetogenesis, catabolismo de ácidos grasos, síntesis de proteínas, proteólisis y síntesis de urea. Se explica cómo las moléculas involucradas tienen varios orígenes y destinos diferentes, y se abordan los procesos anabólicos y catabólicos que ocurren en el cuerpo.
Tipo: Apuntes
1 / 15

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!










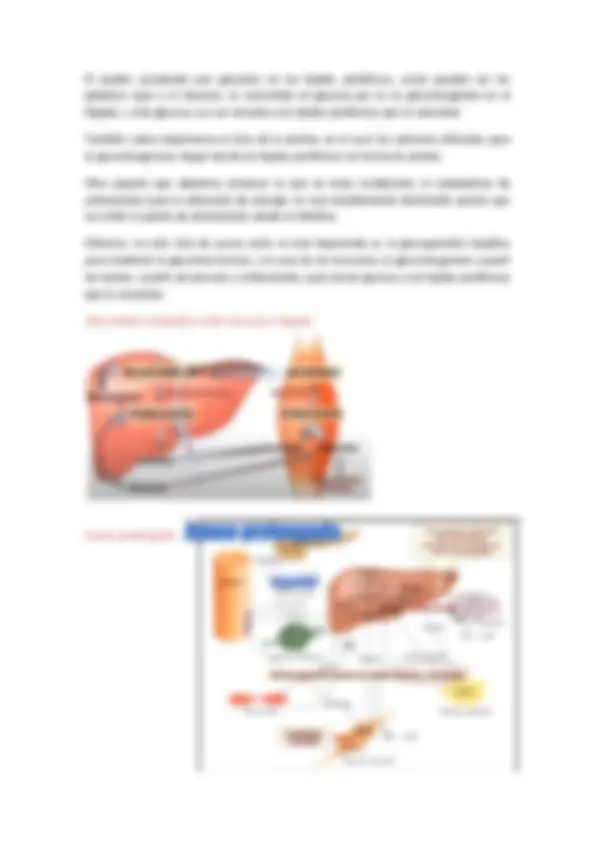
La estrategia básica del metabolismo, es formar ATP, poder reductor y precursores para la biosíntesis; conocer en forma clara y precisa las vías metabólicas involucradas (Gluconeogenesis, glucogenogenesis, glucolisis, glucogenolisis, síntesis y degradación de ácidos grasos, ciclo de krebs, cetogenesis, catabolismo de ácidos grasos, síntesis de proteínas, proteólisis y síntesis de urea). En un determinado momento, no todas estas vías ocurren simultáneamente en todos los tejidos, esto va a depender del estado nutricional y hormonal del individuo. Estas moléculas tienen varios orígenes y destinos diferentes; La glucosa que ingresa dentro de la célula, se fosforila rápidamente a glucosa - 6 fosfato, la cual puede almacenarse como glucógeno, degradarse en vía Piruvato, o convertirse en ribosa 5 fosfato. Cuando la glucosa 6 fosfato y el ATP abundan, se forma glucógeno, por el contrario, cuando se requiere ATP o elementos carbonados para biosíntesis, la glucosa 6 fosfato se Integración metabólica digestiva. Conexiones claves del metabolismo. Glucosa 6 - P Piruvato. Acetil – CoA. GLUCOSA. Glucosa - 1 P. Glucosa - 6 P. 6 - Fosfogluconato. Glucógeno. Fructosa 6 P. Ribosa - 5 P. Piruvato.
degrada por la vía glucolitica; así es como la conversión de glucosa 6 fosfato en Piruvato, puede ser un proceso tanto anabólico como catabólico. El tercer destino principal de la glucosa 6 fosfato, es transformarse a través de las vías de las pentosas y suministrar NADH 3 para la biosíntesis y ribosa 5 fosfato para la síntesis de nucleótidos. La glucosa 6 fosfato, puede formarse por movilización de glucógeno o puede sintetizarse por la vía gluconeogenica a partir de Piruvato y aminoácidos glucogénicos. El bajo nivel de glucosa en sangre, estimula la glucogenolisis y la gluconeogenesis en hígado y en riñón; estos órganos se distinguen por tener glucosa 6 Fosfatasa, que posibilita la liberación de glucosa hacia la sangre. El Piruvato, deriva fundamentalmente de la glucosa 6-Fosfato, el lactato y la alanina, el lactato, es la forma reducida del Piruvato, la fácil reducción del Piruvato, catalizada por la deshidrogenasa, sirve para generar NAD oxidado, el cual a su vez permite que la glucolisis pueda proseguir en condicionas anaeróbicas. El lactato que se forma en los tejidos activos, como el musculo en contracción, se oxida seguidamente a Piruvato, principalmente en el hígado. Otra reacción fácilmente reversible en el citosol, es la transaminacion del piruvato a alanina; por esta vía, varios aminoácidos pueden entrar en las rutas centrales, inversamente, por esta vía pueden sintetizarse varios aminoácidos a partir de precursores glusidicos, así pues la transaminacion, constituye la principal conexión entre el metabolismo de aminoácidos y azucares. Un tercer destino del piruvato es su carboxilacion a Oxaloacetato en el interior de la mitocondria. Esta reacción y la posterior conversión de oxaloacetato a fosfoenol piruvato, Glucosa 6-p. Piruvato. Oxaloacetato. Lactato. Alanina. Acetil – coA. 3 - hidroxi- 3 - metil glutaril-CoA. C- cetogenicos. Colesterol. AA- cetogenicos. Ácidos grasos. Co2.
Las pautas metabólicas del cerebro, el musculo, el tejido adiposo e hígado, son profundamente diferentes. Estado de saciedad. Luego de ingerir alimentos, la relación insulina/glucagon, va a ser elevada, esto quiere decir que va a estar aumentada la concentración de insulina en sangre. Estímulos de la secreción de insulina. o La glucemia y otros metabolitos. o Secreción de hormonas gastrointestinales. o Activación de nervios parasimpáticos. Inmediatamente después de la absorción de nutrientes, la glucosa y los aminoácidos, son volcados a la vena porta y de ahí llegan al hígado. También debemos tener en cuenta, que el intestino, metaboliza parcialmente ciertos aminoácidos como lo son el aspartato la asparragina, el glutamato o la glutamina, para obtener energía. Por su parte, las grasas exógenas, provenientes de los alimentos, llegan a la sangre desde el intestino por el sistema linfático, en forma de quilomicrones. Como resultado del aumento de la concentración de glucosa, se produce la secreción de insulina por las células beta del páncreas. Las células beta de los islotes pancreáticos, funciona como un sensor energético general y de la glucemia particular. La llegada del alimento al tubo digestivo y su posterior absorción, se acompaña de numerosas señales que son: Aumento de los niveles de glucosa y de otros metabolismos en plasma.
Secreción de hormonas gastrointestinales. Activación de nervios parasimpáticos. Otras. Es decir, que la secreción de insulina, está en relación directa a la abundancia de energía, y es justamente la insulina la que desempeña una función primordial en el almacenamiento de la energía. Entonces, recordemos que estamos en un periodo de saciedad, en un periodo de pos ingesta de alimentos, y en un periodo pos absortivo. Entonces, vamos a ver qué pasa en cada órgano luego de absorber estos nutrientes, y recordemos que en este momento, la insulina va a estar elevada, por lo tanto, van a estar activadas las vías anabólicas, las vías de síntesis y de reserva de nutrientes para cuando el organismo este en periodo de no ingesta de alimentos o en periodos de ayuno. Ya sabemos que el intestino utiliza algunos aminoácidos como fuente de energía y que la glucosa y los aminoácidos, llegan al hígado vía vena porta. Entonces, ¿Qué pasa en el hígado con estos nutrientes? La glucosa la puede almacenar en forma de glucógeno a partir de la vía glucogenogenica, puede también, convertir la glucosa en piruvato por glucolisis y el piruvato obtenido puede ser activado a dióxido de carbono en el ciclo de krebs o puede ser transformado en citrato, y va a ir a la síntesis de lípidos o lipogenesis.
En el caso del cerebro, la glucosa es prácticamente el único combustible utilizado, este órgano consume aproximadamente 120 g de glucosa por día, que es el 60% de la glucosa consumida por el organismo en estado de reposo. En el caso del musculo, el musculo va a recibir la glucosa y puede reservarla en forma de glucógeno. Por último, el eritrocito. El eritrocito realiza glucolisis anaeróbica también, entonces, lo que va a estar enviando es lactato al hígado. Estos serian los principales efectos metabólicos que se producen en el periodo de saciedad. Estado de ayuno. “Abstinencia de toda la comida y bebida desde las doce de la noche antecedente” – según el diccionario español. El metabolismo prefiere definir el ayuno como “Acto de abstenerse de todo tipo de comida y en algunos casos de ingesta de líquidos, por un periodo de tiempo”. Ayuno corto o fisiológico: Periodo entre ingesta que puede ir de entre 4 horas o por ejemplo cuando dormimos, que se produce un ayuno de aproximadamente 8 horas. Ayuno prolongado: Más allá de los periodos entre ingestas o más allá de ese periodo de 8 horas durante la noche. Durante el periodo de ayuno, a diferencia del periodo de saciedad, vamos a tener una menor relación de concentración insulina/glucagon. Esto quiere decir que la insulina va a estar disminuida y la concentración de glucagon va a estar elevada. Señales estimulantes de la secreción Glucemia. Ejercicio agotador.
El factor más poderoso que controla la secreción de glucagon por las células alfa del páncreas, es la disminución en la concentración sanguínea de glucosa. Durante la hipoglucemia, se sintetizan y secretan grandes cantidades de glucagon, esto aumenta a su vez la producción hepática de glucosa y actúa como potente factor corrector del estado de hipoglucemia. También estimula la secreción de glucagon en concentraciones elevadas de aminoácidos, sobre todo alanina y arginina; y el glucagon, fomenta entonces la conversión de aminoácidos en glucosa, poniendo más glucosa a disposición de los tejidos. Por su parte, un ejercicio, cuadruplica o quintuplica la concentración sanguínea de glucagon aun sin haber descensos marcados de glucemia, y algunos sugieren que el incremento de glucagon en el ejercicio, podría deberse al incremento de aminoácidos circulantes. No es tan fácil establecer reglas en cuanto al ayuno, esto va a depender tanto de la duración y de las adaptaciones metabólicas de cada individuo. Esto es cuando cesa la entrada de combustibles a nivel intestinal; en estas condiciones, la glucogenolisis hepática, va a ser indispensable para mantener la glucemia normal. La lipogenesis hepática, se va a detener para permitir que el lactato, el piruvato, y los aminoácidos sean desviados hacia la gluconeogenesis, contribuyendo a la producción de glucosa puesto que su aporte externo está interrumpido. En estas condiciones, el ciclo de cori, es una vía importante para mantener los niveles de glucosa sanguínea.
Si el ayuno se prolonga, se hace indispensable la gluconeogenesis a partir de aminoácidos y glicerol. A la no llegada de nutrientes desde el intestino, se suma ahora, que se ha consumido todo el glucógeno hepático, por lo tanto, aquellos tejidos que necesitan glucosa, van a depender de la gluconeogenesis hepática, realizada a partir de lactato, glicerol y alanina. De modo que, los ciclos de cori y de alanina son ahora muy importantes. Sin embargo, estos ciclos no producen una síntesis neta de glucosa, sino que la glucosa sintetizada por el hígado a partir de lactato y alanina, solo reemplazara la que fue metabolizada y convertida en estos productos por los tejidos periféricos. Mientras tanto, el cerebro oxida completamente glucosa a dióxido de carbono y agua. Por esto, en el ayuno prolongado es indispensable que se realice una síntesis neta de glucosa a partir de alguna otra fuente de hidratos de carbono. El glicerol obtenido por los subproductos de la lipolisis del tejido adiposo, es uno de los sustratos utilizados para la síntesis de glucosa en este tipo de ayuno. Es muy importante tener claro que los ácidos grasos no pueden ser utilizados en los animales para la obtención de glucosa, ya que el acetil CoA obtenido por el catabolismo de los ácidos grasos, no puede ser obtenido en intermediarios de 3 carbonos de la gluconeogenesis. Sin embargo, las proteínas, especialmente las del musculo esquelético, aportan mayoritariamente los carbonos necesarios para la síntesis neta de glucosa. Así las proteínas son hidrolizadas dentro de las células musculares para producir aminoácidos. La mayoría de ellos, no son eliminados al torrente circulatorio, sino metabolizados dentro de la misma célula. Solo tres de estos aminoácidos, como es la alanina, la glutamina y la glicina, son liberados en grandes cantidades a la circulación general, de donde pueden ser captados por el riñón y el hígado, que se encargaran de la síntesis neta de glucosa. La alanina, es cuantitativamente el sustrato más importante para la gluconeogenesis en estas condiciones. Como puede verse en el ejemplo, la glutamina liberada a sangre después de la hidrólisis muscular, es transformada en alanina por el epitelio intestinal y volcada nuevamente en la circulación general, llegando de nuevo al hígado. Es importante tener en cuenta, que tanto musculo como riñón, oxidan preferentemente ácidos grasos, dejando la glucosa disponible para otros tejidos. Es evidente, que la gluconeogenesis hepática a partir de aminoácidos en el ayuno prolongado, está estrechamente ligada a la síntesis de urea, puesto que los aminoácidos
transferirán su grupo amino a un alfa cetoacido, antes de ser utilizado como sustrato para la síntesis de glucosa. Ese aminoácido eliminado, tendrá como último destino, la síntesis de urea. Por lo tanto, una activa gluconeogenesis, será acompañada por un aumento en la actividad de la síntesis de la urea. Como puede esperarse, la intervención del tejido adiposo en el ayuno prolongado es trascendental. Recordemos que justamente esos triglicéridos en el tejido adiposo, constituyen la reserva energética más importante del organismo. En el ayuno prolongado, la relación insulina/glucagon es muy baja, por lo cual la glucolisis está muy activada. Esto trae aparejado, un aumento en la concentración de ácidos grasos en sangre, que serán utilizados en lugar de glucosa, por muchos tejidos tales como el musculo, el corazón, en los cuales la oxidación de ácidos grasos inhibe la glucolisis. Por su parte, el cerebro no puede utilizar ácidos grasos como fuente de energía, puesto que ellos no pueden atravesar la barrera hematoencefalica. En contraste, en el hígado, la oxidación de ácidos grasos provee la mayor parte del ATP necesario para la gluconeogenesis. Como hemos visto al estudiar la beta oxidación en el hígado, una cantidad de acetil-CoA, es oxidado completamente en el ciclo de Krebs, y el resto es convertido en cuerpos cetonicos en las mitocondrias hepáticas. Estos cuerpos cetonicos son liberados a la circulación y pueden servir como fuente de energía para aquellos tejidos que cuentan con las enzimas necesarias para introducirlos en el ciclo de krebs, produciendo un ahorro notable de glucosa. Es importante remarcar que los cuerpos cetonicos, si pueden atravesar la barrera hematoencefalica, constituyendo un combustible alternativo para el cerebro cuando están presentes en condiciones suficientemente altas. Debemos tener en cuenta que los cuerpos cetonicos son incapaces de reemplazar totalmente a la glucosa como combustible del cerebro. La presencia de los cuerpos cetonicos en cantidades considerables, disminuye notablemente la proteólisis del musculo esquelético, de modo que mientras se mantenga elevada la concentración de los mismos en sangre, habrá menos necesidad de glucosa y de aminoácidos gluconeogenicos y por consiguiente, menos necesidad de utilizar el tejido muscular como fuente de aminoácidos. Trabajo en conjunto de: Hígado, musculo, intestino y tejido adiposo aseguran el aporte de glucosa para el cerebro.
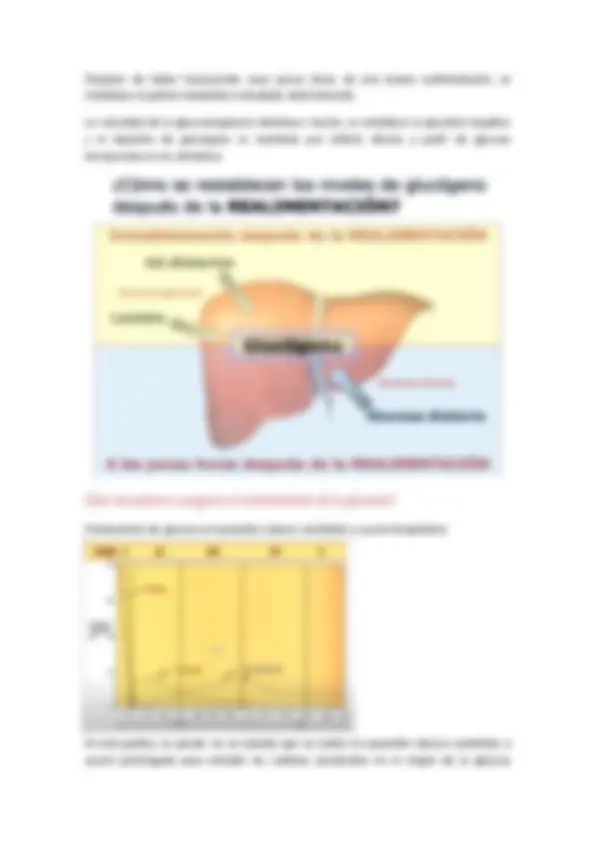
Después de haber transcurrido unas pocas horas de una buena realimentación, se restablece el patrón metabólico estudiado anteriormente. La velocidad de la gluconeogenesis disminuye mucho, se restablece la glucolisis hepática y el depósito de glucógeno se mantiene por síntesis directa a partir de glucosa incorporada en los alimentos. ¿Qué mecanismos aseguran el mantenimiento de la glucemia? Homeostasis de glucosa en pacientes obesos sometidos a ayuno terapéutico: En esta grafica, se puede ver un estudio que se realizo en pacientes obesos sometidos a ayuno prolongado para estudiar los cambios producidos en el origen de la glucosa
circulante y como se mantienen los valores de glucemia normal durante el ayuno prolongado. Para explicar estos efectos, se dividieron en cinco fases: Fase I o fase de buena alimentación, donde la glucosa proviene de los carbohidratos de la dieta, por lo cual, los valores de glucemia descienden a medida que los distintos tejidos captan la glucosa del torrente circulatorio para cubrir las necesidades energéticas. En la fase II, surge la necesidad de mantener esos niveles, por glucogenolisis hepática, es decir, que el glucógeno, es el combustible de reserva de uso inmediato, y debemos recordar que esta reserva es minúscula comparada al depósito de grasa. En la fase III, es a partir de la gluconeogenesis hepática, que comenzó en la fase anterior, y constituye la principal fuente de glucosa sanguínea. Es importante aclarar que estos cambios ocurren aproximadamente a las 20 horas de ayuno, dependiendo de cuán bien alimentado estaba el individuo antes de iniciar el ayuno y de cuanto glucógeno hepático se dispone y de la actividad realizada durante la privación de alimentos. En la fase IV, después de varios días de ayuno, la dependencia de gluconeogenesis no es tan marcada, los cuerpos cetonicos, han alcanzado concentraciones lo suficientemente altas para ser captados y utilizados por el cerebro, satisfaciendo parte de sus necesidades energéticas. Origen de la glucosa sanguínea. Tejidos que utilizan glucosa. Principal combustible del cerebro.