














Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
trabajo importante para tosdo relacionado a biologia}
Tipo: Esquemas y mapas conceptuales
1 / 22

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!















Dr. Miguel Angel Ruiz Barrueto Mg. Waldo Franz Salvatierra Espinola Mg. Luis Gabriel Centeno Calderón Mg. Patricia Lourdes Purizaca Chunga MC. Rolando Tejada Obeso
FACULTAD DE CIENCIAS DE LA SALUD Escuela de Medicina Humana
LOGRO DE SESIÓN:
INTERÉS:
Disponible en: https://www.youtube.com/watch?v=GSmkTEL 3 t 2 I&ab_channel=BiocienciasdeGiraldo
ÁCIDOS: EJEMPLOS
BASES: EJEMPLOS
pH: POTENCIAL DE HIDRÓGENO
▪ El potencial de hidrógeno, pH, es el término que nos indica la concentración de iones hidrógeno en una disolución. Se trata de una medida de la acidez de la disolución.
▪ El término se define como el logaritmo negativo de la concentración de iones hidrógeno, H+.
pH = - log [H+]
Donde: pH = potencial de hidrógenos
- log = logaritmo negativo [H+] = concentración de iones hidrógeno en moles /litro
En una solución, la concentración de hidrogeniones es muy pequeña, por esa razón es que se opta por expresar la acidez de una sustancia en términos de pH.
Problema: Dado que la concentración de hidrogeniones del agua pura es de 10 -^7 M, indique el pH: Datos: H+= 10 -^7 Molar = 10 -^7 moles/litro Aplicando: pH = - log [H+] pH H 2 O = - log [ 10 - 7 ] pH H 2 O = 7
▪ Debido a que los iones H+ se asocian con las moléculas de agua para formar iones hidronio, H 3 O+, el pH también se expresa a menudo en términos de concentración de iones hidronio. ▪ En agua pura a 25 °C de temperatura, existen cantidades iguales de iones H 3 O+ y de iones hidróxido (OH-); la concentración de cada uno es 10 -^7 moles/litro. Por lo tanto, el pH del agua pura es: 7.
CONCEPTO DE POH:
▪ El pOH es una medida logarítmica que indica la concentración de iones hidroxilo (OH-) en una solución acuosa. Así como pH mide cuán ácida es una solución, el pOH mide cuán básica (alcalina) es:
−
Donde: [OH-] = es la concentración molar de iones hidroxilo. Mientras menores el pOH, más básica es la solución. Relación entre pH y pOH. En agua pura a 25 oC: pH + pOH = 14 Esto significa que si conoces el pH, puedes hallar el pOH: pOH = 14 - pH
Ejemplo: ▪ Si una solución tiene pH = 11 ͢ pOH = 14 – 11 = 3 ͢ Es una solución básica, con alta concentración de OH-.
Importancia: ▪ Se usa para estudiar soluciones alcalinas. ▪ Es útil en sistemas tampón y en equilibrio ácido-base. ▪ Complementa el pH en el análisis del estado iónico de una solución.
Actividad: Si en una solución la concentración molar de iones H+^ es 10 -^8 Determinar el pH y el pOH.
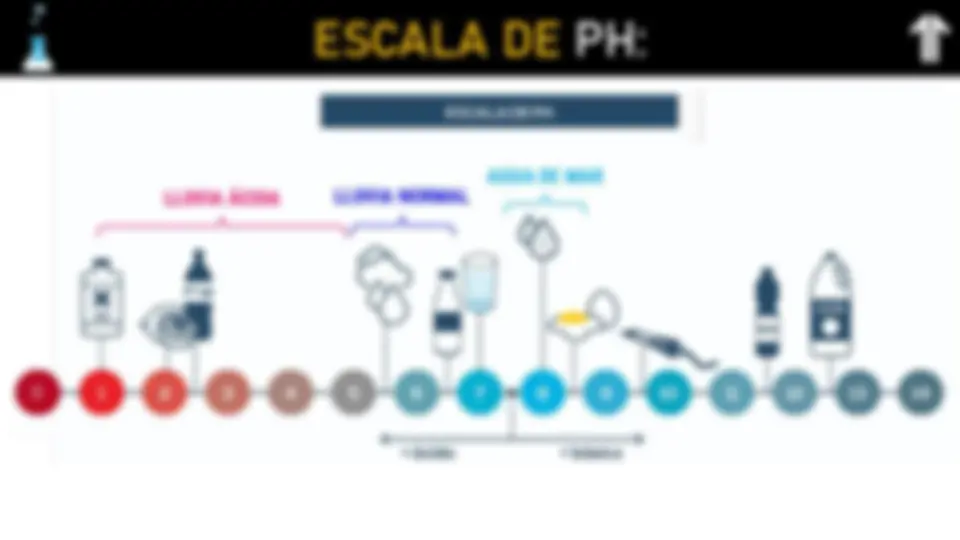
ESCALA DE PH:
ALGUNOS INDICADORES DE PH:
Indicador Color forma ácida
Color forma básica
Zona de viraje (pH) Violeta de metilo Amarillo Violeta 0 - 2
Rojo Congo Azul Rojo 3 - 5
Rojo de metilo Rojo Amarillo 4 - 6
Tornasol Rojo Azul 6 - 8
Fenolftaleín a Incoloro Rosa 8 - 10
VALORACIONES ÁCIDO – BASE: PROBLEMA
Bureta
H 2 SO 4
NaOH
Fenolftaleína
SOLUCIONES BUFFER
▪ Un tampón o buffer es una o varias sustancias químicas que afectan a la concentración de los iones de hidrógeno (o hidronios) en el agua. Siendo que pH es potencial de hidrogeniones, un "buffer" (o "amortiguador") lo que hace es regular el pH.
▪ Cuando un "buffer" es añadido al agua, el primer cambio que se produce es que el pH del agua se vuelve constante. De esta manera, ácidos o bases (álcalis = bases) adicionales no podrán tener efecto alguno sobre el agua, ya que esta siempre se estabilizará de inmediato.
▪ Los amortiguadores (buffers) en los fluidos corporales sirven como una defensa contra el cambio del PH.
ácido acético + acetato de Sodio
Sistemas amortiguadores fisiológicos
CASO CLÍNICO
Miluska una adolescente es llevada por su padre a un hospital cercano, ingresando por emergencia el médico indica a la enfermera que le coloque una solución endovenosa, después de suministrarle el fármaco, Miluska presentó alteraciones en su estado de conciencia; al ver esta alteración repentina se le somete inmediatamente a una gasometría arterial encontrándose los siguientes resultados: pH = 7 , 54 PaCO 2 = 55 mmHg Bicarbonato = 34 mEq/L
El diagnóstico final es: a) Acidosis metabólica b) Alcalosis respiratoria c) Acidosis respiratoria d) Alcalosis metabólica
▪ CASO CLÍNICO: Para resolver este caso clínico estos son los valores normales en una persona.
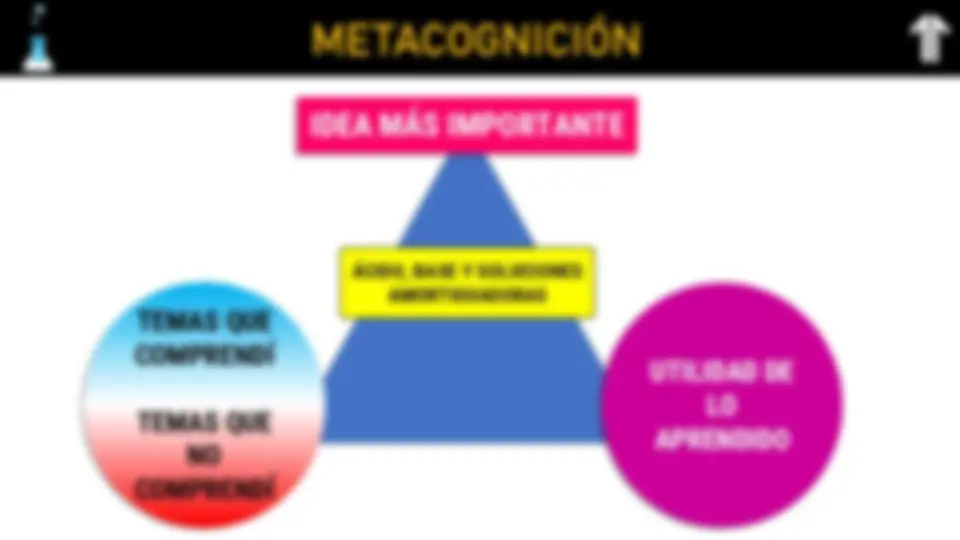
TEMAS QUE
COMPRENDÍ
TEMAS QUE NO
COMPRENDÍ
UTILIDAD DE LO APRENDIDO
METACOGNICIÓN